「Na⁺とかCl⁻とか、記号がごちゃごちゃして覚えられない」
「硫酸イオンってSO₄²⁻?SO₃²⁻?どっちだっけ…」
「そもそもイオンって何?原子と何が違うの?」
「テストで絶対出るのに、全然頭に入らない!」
化学の授業で必ず登場するイオン。 覚える種類が多すぎて、混乱してしまいますよね。
でも実は、イオンは私たちの生活にめちゃくちゃ身近なんです。 塩(食塩)、電池、スポーツドリンク、さらには体の中でも大活躍!
この記事では、中学・高校で必要なイオンを完全網羅。
この記事を読み終わる頃には、「イオンって意外と簡単じゃん!」と思えるはずです。
イオンとは?30秒でわかる基本

一言で説明すると…
イオンとは、電気を帯びた原子や原子団のことです。
原子がイオンになる仕組み
通常の原子(電気的に中性)
原子 = 陽子の数 = 電子の数
例:Na原子 → 陽子11個、電子11個
イオンになると…
電子を失う → 陽イオン(プラス)
電子を得る → 陰イオン(マイナス)
身近な例で理解
食塩(NaCl)を水に溶かすと…
NaCl → Na⁺ + Cl⁻
固体の塩 → ナトリウムイオン + 塩化物イオン
水の中でバラバラになって、電気を帯びた状態に! だから塩水は電気を通すんです。
【完全版】陽イオン(プラスイオン)一覧表

1価の陽イオン(+1の電荷)
| イオン式 | 名前 | 元素/由来 | 覚え方・特徴 |
|---|---|---|---|
| H⁺ | 水素イオン | 水素 | 酸性の正体 |
| Li⁺ | リチウムイオン | リチウム | リチウム電池 |
| Na⁺ | ナトリウムイオン | ナトリウム | 食塩の成分 |
| K⁺ | カリウムイオン | カリウム | バナナに多い |
| Ag⁺ | 銀イオン | 銀 | 銀食器、写真 |
| Cu⁺ | 銅(I)イオン | 銅 | あまり出ない |
| NH₄⁺ | アンモニウムイオン | NH₃+H⁺ | 唯一の多原子陽イオン |
2価の陽イオン(+2の電荷)
| イオン式 | 名前 | 元素 | 覚え方・特徴 |
|---|---|---|---|
| Mg²⁺ | マグネシウムイオン | マグネシウム | にがりの成分 |
| Ca²⁺ | カルシウムイオン | カルシウム | 骨や歯の成分 |
| Ba²⁺ | バリウムイオン | バリウム | X線検査の造影剤 |
| Zn²⁺ | 亜鉛イオン | 亜鉛 | 亜鉛メッキ |
| Cu²⁺ | 銅(II)イオン | 銅 | 青い色(硫酸銅) |
| Fe²⁺ | 鉄(II)イオン | 鉄 | 緑っぽい色 |
| Pb²⁺ | 鉛(II)イオン | 鉛 | 鉛蓄電池 |
3価の陽イオン(+3の電荷)
| イオン式 | 名前 | 元素 | 覚え方・特徴 |
|---|---|---|---|
| Al³⁺ | アルミニウムイオン | アルミニウム | アルミ缶 |
| Fe³⁺ | 鉄(III)イオン | 鉄 | 赤茶色(さび) |
💡 覚え方のコツ:
- 1族元素(Li, Na, K)→ 必ず1価
- 2族元素(Mg, Ca, Ba)→ 必ず2価
- アルミニウムは3族 → 3価
【完全版】陰イオン(マイナスイオン)一覧表

1価の陰イオン(-1の電荷)
| イオン式 | 名前 | 由来 | 覚え方・特徴 |
|---|---|---|---|
| F⁻ | フッ化物イオン | フッ素 | 虫歯予防 |
| Cl⁻ | 塩化物イオン | 塩素 | 食塩、プール |
| Br⁻ | 臭化物イオン | 臭素 | 写真の現像 |
| I⁻ | ヨウ化物イオン | ヨウ素 | うがい薬 |
| OH⁻ | 水酸化物イオン | 水-H⁺ | アルカリ性の正体 |
| NO₃⁻ | 硝酸イオン | 硝酸 | 肥料、火薬 |
| NO₂⁻ | 亜硝酸イオン | 亜硝酸 | 食品保存料 |
| CH₃COO⁻ | 酢酸イオン | 酢酸 | お酢の成分 |
| ClO⁻ | 次亜塩素酸イオン | 塩素+酸素 | 漂白剤 |
| MnO₄⁻ | 過マンガン酸イオン | マンガン+酸素 | 紫色、消毒 |
2価の陰イオン(-2の電荷)
| イオン式 | 名前 | 由来 | 覚え方・特徴 |
|---|---|---|---|
| O²⁻ | 酸化物イオン | 酸素 | 金属酸化物 |
| S²⁻ | 硫化物イオン | 硫黄 | 温泉の臭い |
| SO₄²⁻ | 硫酸イオン | 硫酸 | 最重要! |
| SO₃²⁻ | 亜硫酸イオン | 亜硫酸 | ワインの保存 |
| CO₃²⁻ | 炭酸イオン | 炭酸 | 貝殻、石灰石 |
| CrO₄²⁻ | クロム酸イオン | クロム+酸素 | 黄色 |
| Cr₂O₇²⁻ | 二クロム酸イオン | クロム×2 | オレンジ色 |
3価の陰イオン(-3の電荷)
| イオン式 | 名前 | 由来 | 覚え方・特徴 |
|---|---|---|---|
| PO₄³⁻ | リン酸イオン | リン酸 | 骨の成分、肥料 |
| N³⁻ | 窒化物イオン | 窒素 | あまり出ない |
絶対忘れない!イオンの覚え方

規則性で覚える
ハロゲン(17族)
F⁻、Cl⁻、Br⁻、I⁻ → すべて-1価 「ふっくらブラジャー愛」
酸素を含むイオン(オキソ酸イオン)
| 元素 | 多い酸素 | 少ない酸素 |
|---|---|---|
| 硫黄 | SO₄²⁻(硫酸) | SO₃²⁻(亜硫酸) |
| 窒素 | NO₃⁻(硝酸) | NO₂⁻(亜硝酸) |
| 塩素 | ClO₄⁻(過塩素酸) | ClO⁻(次亜塩素酸) |
規則:「亜」がつくと酸素が1個少ない!
イオン式の正しい書き方
基本ルール
1. 価数の表記
正しい:Na⁺、Ca²⁺、Al³⁺
間違い:Na¹⁺、Ca⁺⁺、Al⁺³
2. 価数は右上に小さく
正しい:SO₄²⁻
間違い:SO₄₋₂、(SO₄)²⁻
3. 多原子イオンはまとめて
正しい:NH₄⁺
間違い:N³⁺H₄⁺
化合物の化学式の作り方
電気的中性の法則
陽イオンの+と陰イオンの-が打ち消し合う!
例1:塩化ナトリウム
Na⁺ + Cl⁻ → NaCl
(+1) + (-1) = 0 ✓
例2:硫酸カルシウム
Ca²⁺ + SO₄²⁻ → CaSO₄
(+2) + (-2) = 0 ✓
例3:リン酸カルシウム
3Ca²⁺ + 2PO₄³⁻ → Ca₃(PO₄)₂
3×(+2) + 2×(-3) = 0 ✓
テストに出る!重要なイオンTOP10
絶対覚えるべきイオン
- Na⁺ – ナトリウムイオン(食塩)
- Cl⁻ – 塩化物イオン(食塩)
- H⁺ – 水素イオン(酸性)
- OH⁻ – 水酸化物イオン(アルカリ性)
- SO₄²⁻ – 硫酸イオン(硫酸)
- NO₃⁻ – 硝酸イオン(硝酸)
- CO₃²⁻ – 炭酸イオン(炭酸)
- Ca²⁺ – カルシウムイオン(石灰)
- Cu²⁺ – 銅イオン(銅)
- Fe³⁺ – 鉄(III)イオン(さび)
よく出る組み合わせ
| 化合物 | イオンの組み合わせ | 用途 |
|---|---|---|
| NaCl | Na⁺ + Cl⁻ | 食塩 |
| CaCO₃ | Ca²⁺ + CO₃²⁻ | 石灰石、チョーク |
| H₂SO₄ | 2H⁺ + SO₄²⁻ | 硫酸(バッテリー) |
| Ca(OH)₂ | Ca²⁺ + 2OH⁻ | 消石灰 |
| CuSO₄ | Cu²⁺ + SO₄²⁻ | 硫酸銅(農薬) |
イオンが活躍する身近な例

体の中のイオン
ナトリウムイオン(Na⁺)とカリウムイオン(K⁺)
- 神経の信号伝達
- 筋肉の収縮
- 体液のバランス
スポーツドリンクに入っているのはこのため!
カルシウムイオン(Ca²⁺)
- 骨と歯の形成
- 血液凝固
- 筋肉収縮
日用品のイオン
次亜塩素酸イオン(ClO⁻)
- キッチンハイター
- プールの消毒
- トイレの漂白剤
炭酸イオン(CO₃²⁻)
- 重曹(炭酸水素ナトリウム)
- 入浴剤の泡
- パンを膨らませる
工業でのイオン
めっき
Cu²⁺ + 2e⁻ → Cu(銅メッキ)
Zn²⁺ + 2e⁻ → Zn(亜鉛メッキ)
電池
正極:Cu²⁺ → 電子を受け取る
負極:Zn → Zn²⁺ + 2e⁻
イオン反応式の書き方
基本的な手順
Step1:物質をイオンに分ける
HCl → H⁺ + Cl⁻
NaOH → Na⁺ + OH⁻
Step2:反応するイオンを組み合わせる
H⁺ + OH⁻ → H₂O
Step3:両辺に残るイオンを書く
H⁺ + Cl⁻ + Na⁺ + OH⁻ → Na⁺ + Cl⁻ + H₂O
沈殿反応の例
塩化銀の沈殿:
Ag⁺ + Cl⁻ → AgCl↓(白色沈殿)
硫酸バリウムの沈殿:
Ba²⁺ + SO₄²⁻ → BaSO₄↓(白色沈殿)
イオンの価数を簡単に判断する方法
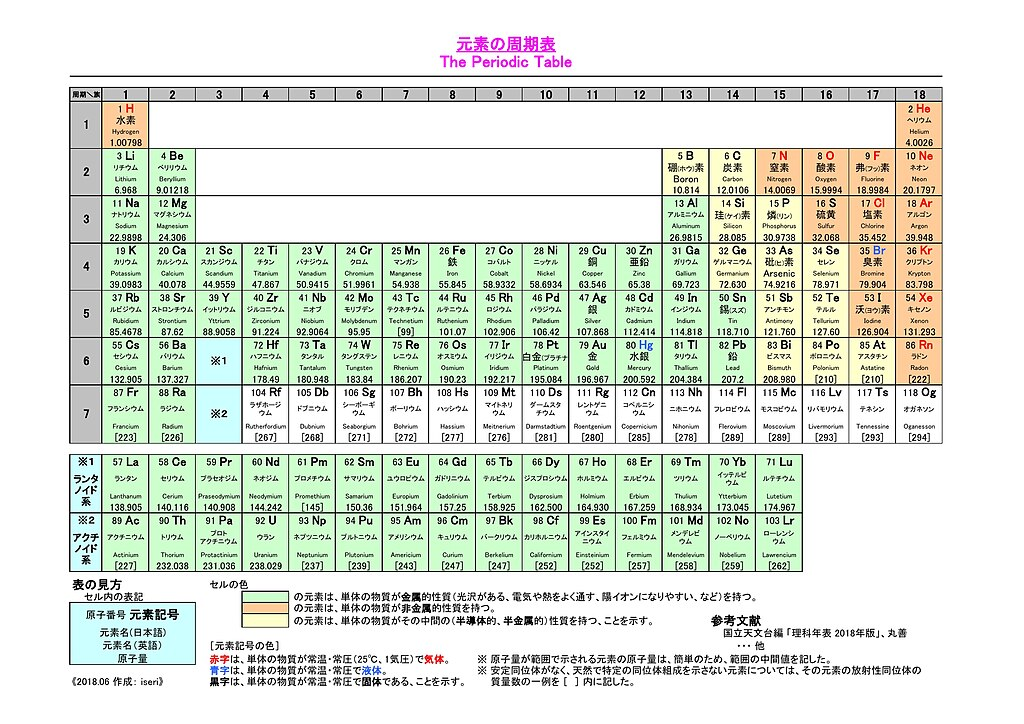
周期表から判断
| 族 | 価数 | 元素例 |
|---|---|---|
| 1族 | +1 | Li, Na, K |
| 2族 | +2 | Mg, Ca, Ba |
| 13族 | +3 | Al |
| 16族 | -2 | O, S |
| 17族 | -1 | F, Cl, Br, I |
化合物から逆算
例:Fe₂O₃の鉄の価数は?
酸素:-2が3個 = -6
全体で0になるには...
鉄:2個で+6 → 1個は+3
答え:Fe³⁺
よくある間違いと注意点
間違い1:イオン式と化学式の混同
❌ 間違い:「硫酸はSO₄²⁻」
✅ 正解:
- 硫酸(物質):H₂SO₄
- 硫酸イオン:SO₄²⁻
間違い2:価数の書き方
❌ **間違い:**Ca⁺⁺、Al⁺⁺⁺
✅ **正解:**Ca²⁺、Al³⁺
間違い3:多原子イオンの分解
❌ **間違い:**NH₄⁺ → N³⁺ + 4H⁺
✅ **正解:**NH₄⁺はこれで1つのイオン
間違い4:亜硝酸と硝酸の混同
- 硝酸イオン:NO₃⁻(酸素3個)
- 亜硝酸イオン:NO₂⁻(酸素2個)
「亜」がつくと酸素が少ない!
テスト対策:出題パターン別攻略法
パターン1:イオン式を書く問題
例:「硫酸イオンのイオン式を書け」 → SO₄²⁻
ポイント:価数の位置と書き方に注意
パターン2:化合物の組成
例:「炭酸カルシウムを構成するイオンは?」 → Ca²⁺とCO₃²⁻
ポイント:電気的中性を確認
パターン3:イオン反応式
例:「塩酸と水酸化ナトリウムの中和反応」 → H⁺ + OH⁻ → H₂O
ポイント:反応に関係ないイオンは省略可
まとめ:イオンはパターンで覚えよう!
イオンの化学式について、完全にマスターできましたね!
絶対に覚えておくべきポイント:
✅ 陽イオンは電子を失ってプラス
✅ 陰イオンは電子を得てマイナス
✅ 1族→+1、2族→+2、17族→-1の規則
✅ 「亜」がつくと酸素が少ない
✅ 化合物は電気的に中性
効率的な覚え方:
📝 Step1 → 重要10個を完璧に
🧪 Step2 → 族での規則性を理解
イオンの本質は…
原子が安定になろうとする性質の現れ。 電子のやり取りで、より安定な状態を目指す。 これが化学反応の原動力!
テストで必ず出るイオン式。 この記事を何度も見返して、完璧にマスターしてください!







