理科や化学の授業でおなじみの炎色反応。試験管に金属を入れて炎にかざすと、赤、緑、紫、黄色…とさまざまな色の光を発しますよね。
でも、ふと疑問に思いませんか?
「なぜ金属によって出る色が違うの?」
今日は、炎色反応で色が変わる本当の理由を、高校生でも理解できるようにやさしく解説します。
色の仕組みを知れば、化学がもっと面白くなりますよ!
炎色反応ってなに?簡単に説明します
炎色反応とは、特定の金属元素を炎に入れると、その金属特有の色の光を発する現象のことです。
この反応を使えば、どの金属が含まれているかを見分けることができるんです。
なぜ色が違うの?電子のエネルギー変化がカギ!
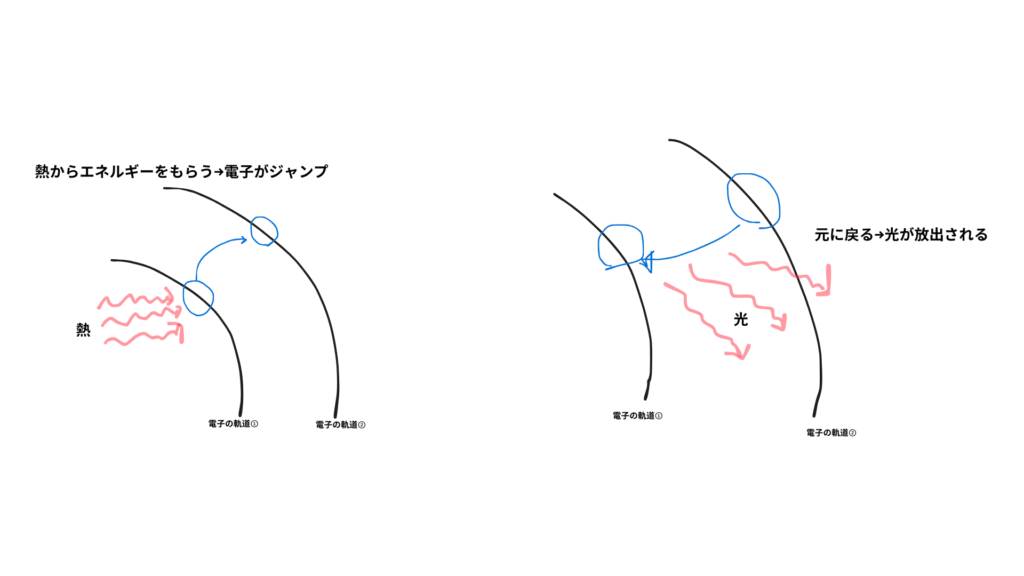
ここが一番大事なポイントです。
ステップで見てみましょう:
- 金属原子に熱エネルギー(炎の熱)を加える
- 原子の中の電子が高いエネルギー状態にジャンプ(これを「励起状態」と言います)
- 電子は一瞬で元の低いエネルギー状態に戻る(これを「基底状態」と言います)
- 戻るときに特定の波長の光を放つ→これが「色」になる
この放たれた光が、私たちの目に「色」として見えるわけです。
なぜ金属ごとに色が違うの?
それは、電子がジャンプするエネルギーの差が元素ごとに違うからなんです。
- エネルギーの差が大きい→青や紫の光
- エネルギーの差が小さい→赤やオレンジの光
元素によって電子の配置が違うので、色も変わるということですね。
元素ごとの代表的な色一覧
| 元素 | 発光色 | 覚え方のコツ |
|---|---|---|
| ナトリウム(Na) | 黄色(濃い黄) | カレーにナトリウム=黄色 |
| 銅(Cu) | 緑色〜青緑 | 銅像=緑色 |
| カリウム(K) | 紫色 | カリっと紫の芋けんぴ |
| リチウム(Li) | 赤色 | リチウム→リップ(赤) |
| ストロンチウム(Sr) | 深赤色 | ストロベリー色で覚える |
| バリウム(Ba) | 黄緑色 | バリウム=バナナ=黄緑 |
炎色反応はどこで使われてる?

日常生活での応用例
- 花火の着色:赤はストロンチウム、緑はバリウム、青は銅など(実は化学技術なんです!)
- 科学捜査や金属検出
- 学校の化学実験(定性分析)
- 分光分析装置の原理
花火を見るときは、「あ、この緑色はバリウムが入ってるんだな」なんて考えると楽しくなりますね。
よくある誤解と注意点
炎の色=物質の色ではない
同じ金属でも、燃焼条件や含有量で見える色が変化することがあります。
電子の移動によって発生する色なので、物質自体の色ではないんです。
炎の色がかぶって見分けにくいこともある
例えばナトリウムの黄色は非常に強いため、他の金属の色を打ち消してしまうことも。
実験のときは要注意です。
正確に調べるには専用機器を使う
色の違いが微妙なときは、機器を使って光の波長を測定することが推奨されます。
まとめ
炎色反応の「色の違い」は、元素ごとに異なる電子のエネルギー構造が生み出す現象です。
この違いを利用することで、私たちは肉眼で見えない原子の世界を”色”で感じることができるんです。
ポイントまとめ
- 炎色反応は電子のエネルギー変化によって光(色)を放つ現象
- 元素によって電子配置が違う→色も変わる
- 花火、実験、分析など多方面で活用されている
- ナトリウムの強い黄色には特に注意!
「なんとなく実験で見ていた炎色反応」も、その裏側を知るともっと楽しくなります。
もしあなたが理系に興味があるなら、次は分光分析や量子力学の世界にもぜひ触れてみてくださいね。
化学って、身の回りの現象と深くつながっているから面白いですよね。
今度花火を見るときは、きっと違った楽しみ方ができるはずです!