高校や大学で化学を学んでいると、「電子殻(でんしかく)」と「電子軌道(でんしきどう)」という言葉によく出会います。
実は、意味や役割が大きく違います。
人によってはこの2つを混同して、間違えてしまうことも多いんです。
この記事では、「電子殻」と「電子軌道」の定義や違いを、図や具体例を交えながらわかりやすく解説します。
電子殻とは何か?|原子の中の「階層」
電子殻の基本的な考え方
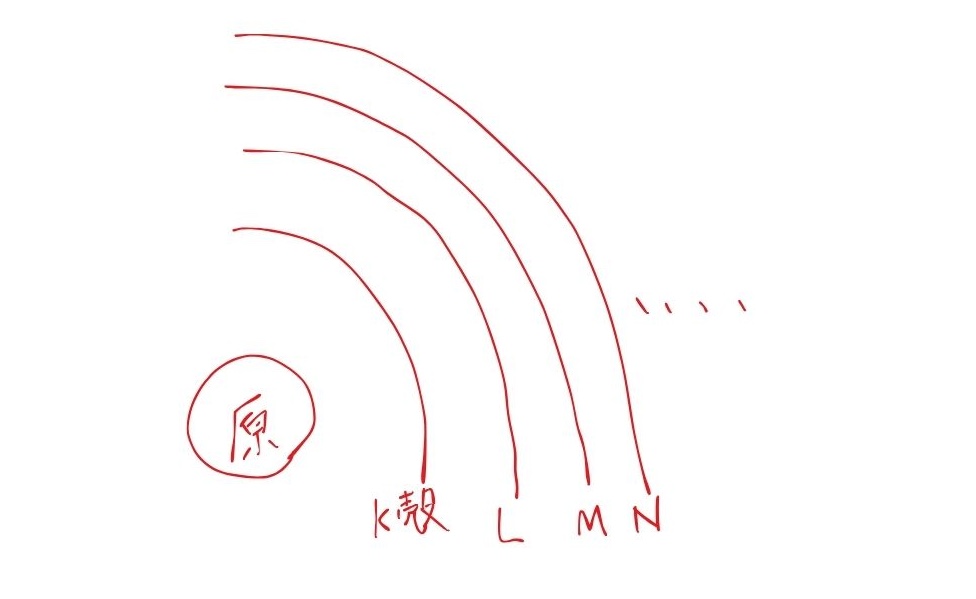
「電子殻(でんしかく)」とは、原子内の電子が存在するエネルギーの階層のことです。
よく「玉ねぎの皮」のような構造に例えられます。
原子核を中心として、電子は決まったエネルギーの層に存在しています。
内側から外側に向かって、K殻、L殻、M殻、N殻…という名前がついています。
具体例で理解しよう
水素原子の場合
- 電子は1個だけ
- 最も内側のK殻(第1電子殻)に存在
- 一番エネルギーが低い安定した状態
炭素原子の場合
- 電子は6個
- K殻に2個、L殻に4個の電子が配置
- 内側から順番に電子が入っていく
電子殻の重要なルール
各殻に入る電子の数は決まっている
- K殻:最大2個
- L殻:最大8個
- M殻:最大18個
- N殻:最大32個
電子は内側から順番に入る
- エネルギーの低い内側の殻から先に電子が配置される
- これを「構築原理」と呼ぶ
電子殻は電子を収納する「エネルギーの階層」を表しています。
次は、同じ殻の中でもさらに細かく分かれる「電子軌道」について見ていきましょう。
電子軌道とは何か?|電子が「いる場所」の形
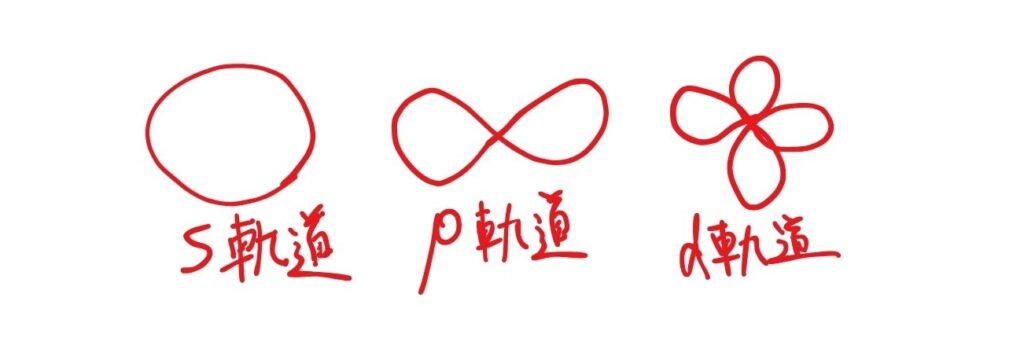
電子軌道の基本的な考え方
「電子軌道(でんしきどう)」とは、電子が存在する確率が高い空間の領域(通路)のことです。
量子力学という物理学の理論にもとづく概念で、s軌道、p軌道、d軌道、f軌道などの種類があります。
電子は粒子でありながら波の性質も持っているため、「この場所に必ずいる」とは言えません。
代わりに「この領域にいる確率が高い」という表現をします。
軌道の種類と形
s軌道(エス軌道)
- 球のような形をしている
- どの電子殻にも1つずつ存在
- 最大2個の電子が入る
p軌道(ピー軌道)
- ダンベルのような形(♾️)をしている
- L殻以降に存在(K殻にはない)
- 3つの軌道(px、py、pz)があり、合計で最大6個の電子が入る
d軌道(ディー軌道)
- より複雑な形をしている
- M殻以降に存在
- 5つの軌道があり、合計で最大10個の電子が入る
f軌道(エフ軌道)
- 非常に複雑な形をしている
- N殻以降に存在
- 7つの軌道があり、合計で最大14個の電子が入る
具体例で理解しよう
炭素原子(6個の電子)の場合
- K殻:1s軌道に2個の電子
- L殻:2s軌道に2個、2p軌道に2個の電子
- 電子配置は「1s² 2s² 2p²」と表記
酸素原子(8個の電子)の場合
- K殻:1s軌道に2個の電子
- L殻:2s軌道に2個、2p軌道に4個の電子
- 電子配置は「1s² 2s² 2p⁴」と表記
電子軌道は、電子が「どんな形の場所にいるか」を表す空間的な概念です。
次は、この2つの違いをはっきりと整理してみましょう。
電子殻と電子軌道の違い|5つのポイントで比較
基本的な違いを表で確認
| 比較のポイント | 電子殻 | 電子軌道 |
|---|---|---|
| 意味 | エネルギーの階層 | 電子の存在確率が高い空間領域 |
| 表記 | K殻、L殻、M殻など | s軌道、p軌道、d軌道など |
| 捉え方 | エネルギーレベル | 空間の形 |
| 関係性 | 大きな枠組み | 電子殻の中の詳細な構造 |
| 数 | 1つの殻に1つの名前 | 1つの殻に複数の軌道 |
詳しい違いを5つのポイントで説明
ポイント1:概念の大きさが違う
- 電子殻:大まかな「階層」を表す
- 電子軌道:その階層の中の「細かい部屋」を表す
ポイント2:表現するものが違う
- 電子殻:エネルギーの高さと領域を表す
- 電子軌道:電子がいる空間の形を表す
ポイント3:名前の付け方が違う
- 電子殻:K、L、M、N…(アルファベット)
- 電子軌道:s、p、d、f…(小文字のアルファベット)
ポイント4:数の関係が違う
- 電子殻:1つのエネルギー帯に1つの名前
- 電子軌道:1つの電子殻に複数の軌道が存在
ポイント5:歴史的な発見順序
- 電子殻:先に発見された古典的な概念
- 電子軌道:量子力学の発展とともに生まれた新しい概念
関係性をアパートで例えると
電子殻と電子軌道の関係は、アパートで例えるとわかりやすいです。
アパート全体 = 原子
- 1階 = K殻
- 2階 = L殻
- 3階 = M殻
各階の部屋 = 電子軌道
- 1階:1s という部屋が1つ
- 2階:2s という部屋1つ + 2p という部屋3つ
- 3階:3s という部屋1つ + 3p という部屋3つ + 3d という部屋5つ
住人 = 電子
- 各部屋には最大2人まで住める
- 1階から順番に住人が入る
まとめ
「電子殻」と「電子軌道」は、どちらも電子の配置を説明する重要な用語ですが、その意味は大きく違います。
電子殻
- 原子内のエネルギーの階層
- K殻、L殻、M殻などで表現
- 大まかな枠組みを示す
電子軌道
- 電子の存在確率が高い空間領域
- s軌道、p軌道、d軌道などで表現
- 空間の形や詳細な構造を示す
2つの関係
- 電子殻が「階」なら、電子軌道は「部屋」
- 電子殻の中に複数の電子軌道が存在
- どちらも電子の振る舞いを理解するために必要
この記事が少しでも皆さんの役に立てば嬉しいです。
ここまで楽しめた人は、電子のスピンなんかも調べてみるといいと思います。







